Catégorie:Taux de calcaire

Le calcaire est une forme de calcium, qui est un élément jouant un rôle majeur dans la formation des sols, dans la formation et la floculation de l'humus et du complexe argilo-humique, dans la régulation des phénomènes d'échanges transmembranaires, c'est aussi un aliment des microorganismes, des plantes et des animaux.
Le calcium est présent dans tous les sols, mais sous différentes formes et en proportion variable.
Les différentes formes de calcium dans le sol
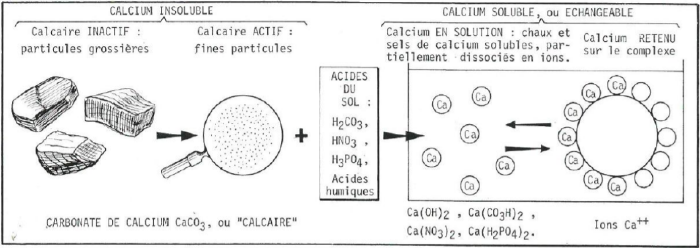
Le calcium insoluble
Le calcaire inactif et le calcaire actif sont liées à l’altération de la roche mère, on les retrouve donc surtout dans les sols de nature calcaire.
Le calcaire inactif
Le calcaire inactif (carbonate de calcium) est celui qui se trouve à l'état grossier, c'est-à-dire celui présent sous forme de blocs, de cailloux, de graviers ou de sables calcaires. L'action de l'acide carbonique des eaux de pluie est quasi inexistante sur ces matériaux. Il existe une autre forme de calcaire inactif, c'est celle qui correspond au calcium contenu dans des minéraux silicatés comme les feldspaths, les micas, les amphiboles ou les pyroxènes.
Le calcaire actif
Le calcaire actif est aussi du carbonate de calcium, mais celui-ci est à l'état pulvérulent (sous des formes plus fines) avec des particules de la taille des limons (20 µm) ou de certaines argiles (2 µm). Ces particules sont facilement attaquables par l'acide carbonique des eaux de pluie ou par les acides organiques du sol. Le carbonate de calcium est transformé en bicarbonate de calcium soluble qui va saturer le complexe adsorbant.
Le calcium soluble
Le calcium soluble
Le calcium soluble est celui qui se trouve ou est apporté sous forme de bicarbonate Ca(CO3H)2, de chaux Ca(OH)2, de nitrate de calcium Ca(NO3)2 ou de phosphate monocalcique Ca(H2PO4)2. Toutes ces formes libèrent des ions Ca2+ dans la solution du sol qui sont capables d’être adsorbés sur le complexe argilo-humique où se font les échanges cationiques.
Le calcium échangeable
Le calcium échangeable est représenté par le calcium adsorbé sur les colloïdes argilo-humiques et plus généralement sur les complexes adsorbants. Généralement, il s'établit un équilibre entre les ions Ca2+ adsorbés et les ions Ca2+ libres dans la solution du sol. Contrairement à certains ions qui peuvent être immobilisés durablement, voire définitivement (K, NH4) sur les complexes adsorbants, les ions calcium restent toujours échangeables. Le calcium solubilisé dans la solution du sol, toujours plus abondant que le calcium adsorbé, et ce dernier, constituent la totalité du calcium échangeable.
Les quantités de calcium présentes sous chaque forme, définissent l’état calcique du sol. La CEC (capacité d’échanges cationiques) des analyses chimiques correspond à cette capacité d’échanges cationiques sur le complexe argilo-humique du sol. Certains laboratoires mesurent aussi le taux de saturation en Ca2+, c’est le ratio Ca/CEC.
Rôle du calcium sur la structure du sol
Les argiles et l’humus sont des composés pouvant être présents sous deux états différents : dispersés ou floculés. Cette propriété fait d’eux des colloïdes. A l’état dispersé (flacon gauche), l’argile et l’eau ne peuvent pas être séparés, ils forment un mélange homogène. En revanche, si l’on ajoute un ion floculant tel que le Ca2+, l’argile va changer d’état et passer sous forme floculée (flacon droit) ce qui a pour conséquence la création d’agrégats argileux qui vont se séparer en partie de l’eau.

C’est pourquoi le chaulage (apport d'amendements calciques ou calco-magnésiens à un sol pour en corriger l'acidité) a un effet bénéfique sur la structure du sol, il permet de maintenir ou d’améliorer la stabilité structurale. Les cations Ca2+ présents dans les amendements calcaires jouent donc un rôle de liaison entre les argiles et les humus tous deux chargés négativement. D’autres cations comme le Mg2+ ont aussi cette capacité. Les cations monovalents (1 seule charge +, ex : Na+ et K++ ) ont un pouvoir floculant plus faible sur les argiles voir nul sur l’humus.
Au champ, un sol bien pourvu en Ca2+ aura un ratio Ca/CEC>65%. Cela favorise le maintien d’une structure grumeleuse avec une bonne perméabilité à l’eau et à l’air avec des agrégats plus résistants à la dispersion causées par les pluies. A l’inverse, un sol avec un mauvais état calcique et donc avec un faible ratio Ca/CEC aura tendance à se compacter et donc à s’asphyxier.
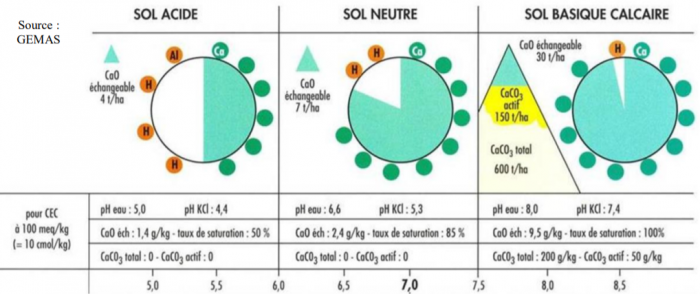
Lien entre l’état calcique du sol et le pH
L’état calcique est en étroite relation avec le pH du sol qui se mesure par la concentration en protons H+. En situation de sol acide (Ex : pH=5), les protons H+ sont plus importants en proportion que les ions Ca2+, ils remplacent donc les ions calcium sur le complexe adsorbant, le taux de saturation en calcium est faible (ex : Ca/CEC=50%).
Pour remonter ce pH, le chaulage est indispensable. Les bases présentes dans les amendements (ex : OH- ) vont capter les protons H+ sur le complexe permettant ainsi aux ions Ca2+ du produit de se fixer sur les sites ainsi libérés. Ce transfert de cations permet donc d’augmenter le pH et le ratio Ca/CEC et ainsi retrouver un état calcique favorable (ex : en sol neutre, pH=6.6 et Ca/CEC=85%).
En présence de calcaire actif, la quantité de CaO échangeable dans la solution du sol est plus importante et le taux de saturation du complexe adsorbant en Ca est maximal, le pH est basique. Il est important de rappeler que les organismes du sol sont sensibles aux variations de pH, il peut donc y avoir des conséquences sur la transformation et l’évolution des matières organiques (ex : minéralisation). Il faut éviter de remonter trop brutalement le pH.
En grandes cultures, les carences sont très rares. Un sol déficitaire en Ca2+ est synonyme de pH très faible et dans ces conditions les problèmes sur les cultures sont liées généralement à la toxicité aluminique. En effet, quand le pH est inférieur à 5.5, les ions aluminium deviennent solubles dans la solution du sol (et absorbables par la plante) et causent des dégâts importants sur les cultures (ralentissement de la croissance, biomasse plus faible, blocages…).
Sources
- Le calcium dans le sol - Chambre d'Agriculture Pays de la Loire
- Le calcium et le magnésium - Ecosociosystemes.fr
Annexes
Pages dans la catégorie « Taux de calcaire »
Cette catégorie comprend 3 pages, dont les 3 ci-dessous.