Indicateurs biologiques de la qualité du sol
Voici plusieurs tests permettent d’accéder à un résultat indicatif de la qualité biologique d’un sol.
Rôle des organismes
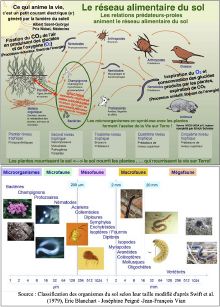
Le sol est un écosystème complexe dans lequel interagissent les matrices minérales et organiques, les fluides liquides et gazeux, des organismes macroscopiques et microscopiques. C’est un milieu vivant où de multiples organismes vivent en communauté : des bactéries, des champignons, des algues, des animaux ou des plantes. On peut les classer selon plusieurs critères comme par exemple leur taille, leur régime alimentaire, leur habitat ou leur fonction écologique.
On peut mesurer l'ensemble de ces éléments par des tests de terrain ou au laboratoire. Normés ou non, ces tests nous renseignent sur l’aspect biologique (respiration microbienne, abondance faunistique...), sur l’aspect physique du sol (la texture, l’état structural, l’infiltration, la résistance, la présence d’eau...) et sur l’aspect chimique (acidité ou alcalinité, teneur en carbone, teneur en azote...).
La faune participe à la formation et à l’évolution du sol. Ces organismes sont les principaux agents du cycle des éléments nutritifs : ils régulent la dynamique de la matière organique du sol et l’absorption des nutriments par la végétation, interviennent dans la séquestration du carbone et les émissions de gaz à effet de serre, modifient la structure physique du sol et le régime des eaux, et améliorent la santé des végétaux. Toutes ces fonctions garantissent la bonne fertilité des sols et donc une bonne qualité des sols.
Classification des organismes
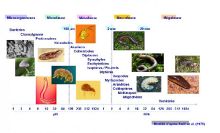
On peut distinguer 4 sous-groupes, différenciés selon leur taille :
- La mégafaune (organismes supérieurs à 10 cm) comme les mammifères, les reptiles…
- La macrofaune (organismes de 4 à 80 mm) comme les lombrics, les insectes, les myriapodes…
- La mésofaune (organismes de 0,2 à 4 mm) comme les acariens, les collemboles…
- La microfaune (organismes inférieurs à 0,2 mm) comme les protozoaires, les nématodes…
Les indicateurs
La qualité de cette faune résulte de la diversité génétique, de la diversité des organismes et de la diversité écologique. On évalue cette qualité à partir d’indicateurs faunistiques pour déterminer la diversité de la faune et à partir d'indicateurs microbiologiques pour déterminer l’activité biologique, l’abondance et la diversité des micro-organismes.
Les indicateurs faunistiques prennent sens dans le cadre d’évaluation des risques environnementaux dans des terrains contaminés/pollués, de rendre compte de la fertilité du sol et de l'impact de différentes pratiques agricoles sur la qualité des sols.
Les indicateurs microbiologiques prennent sens dans le cadre d'une baisse de rendement, pour connaître l'impact des intrants ou des activateurs sur la qualité des sols, connaître la qualité des espaces verts et déterminer l'impact du changement des pratiques agricoles.
Les résultats de ces tests seront :
- L'abondance : le nombre d'individus au m² (global ou par catégories).
- La biomasse : la masse d’individus au m² (g/m²).
- La richesse : le nombre d'espèces.
Etude de la macrofaune
Etude des lombrics (macrofaune)
Les lombrics, vers de terre, sont des êtres vivants très importants pour la vie d’un sol. En effet, ils garantissent de nombreux services grâce à leur activité biologique. Ils participent à la formation de la terre végétale : brassage répété du sol, incorporation de matières organiques, effet du fouissage, rejet de turricules ( bioturbation qui contiennent de nombreux éléments du sol), cycle global érosion-sédimentation avec des transferts hydriques et aériens de fines particules de sol ramenés en surface.
La méthode Bouché
La zone d'échantillonnage est de 1 m².
- Nettoyer délicatement la surface (couper la végétation et ôter la litière ou les amas organiques).
- Appliquer 3 arrosages de solution formolée ou d’un extractant chimique (ex: pour 1m², utilisez 10 litres de solution moutardée) à 15 minutes d'intervalle.
- Prélever les lombriciens à la surface du sol puis effectuer un grattage superficiel jusqu'à 1 cm de profondeur pour récupérer les individus non récoltés. Faites un prélèvement physique sur la zone : extraire un bloc de terre (25x25x20 cm) et trier manuellement.
- Mettre les individus trouvés dans du formol 4% (pour la conservation) et procéder à la reconnaissance des espèces.
Matériel : Une bêche, des bassines, du formol.
: Rapide.
: Destruction de la faune
Etude des macro-invertébrés (taille moyenne supérieure à 10 mm)
La méthode TSBF et IndVal
- Délimiter une partie de sol de 25 cm de côté et 30 cm de profondeur.
- Partager l'échantillon en 3 strates, suivant la profondeur soit : 0-10 cm, 10-20 cm et 20-30 cm.
- Possibilité d'utiliser une solution formolée à 0,2% ou une solution à base de moutarde pour extraire les macro-invertébrés du sol (jusqu'à une profondeur de 15 cm).
- Trier manuellement la faune puis procéder à la reconnaissance des espèces.
- Indicateur Biologique de la Qualité des Sols : IBQS= ∑ln(Di+1)xSi IBQSЄ[0;20]. Di : densité moyenne de l'espèce i dans un site (obtenue avec méthode TSBF). Si : valeur indicatrice du taxon (avec la méthode IndVal).
Matériel : Une bêche, des bassines, du formol.
: Fiable.
:
- Long.
- Destruction de la faune.
- L'aspect "répulsif" du formol réduit la qualité de l'échantillonnage (fuite d'une partie de la faune).
- Difficulté d’injecter le répulsif dans un volume précis (utiliser un cadre pour limiter le terrain).
Etude des peuplements d'insectes aériens à larves souterraines
La cage à émergence
Placer la cage à émergence sur le sol. Attendre quelques jours puis collecter les insectes présents dans la nasse. Procéder à l'identification.
Matériel : Une nasse ou une cage à émergence.
: Simple et facilement transférable d'un endroit à un autre.
: Le temps d'étude est long (la passage du stade de larve au stade adulte prend plusieurs jours).
Etude de l’ensemble macro et mésofaune
L'extracteur de Berlèse Tullgren
- Cette extraction est souvent réalisée après tamisage de l'échantillon de sol. Pour la mésofaune, on réalise l'extraction sur plusieurs petits échantillons homogènes.
- Placer un volume connu de terre dans un entonnoir dont le trou de sortie est fermé par un grillage.
- Placer un récipient contenant un liquide conservateur sous le trou de l'entonnoir.
- Placer l'ensemble sous une lampe à incandescence (source de chaleur).
- Effectuer la reconnaissance des espèces trouvées.
Matériel : Un entonnoir, de l'alcool à 70% (un liquide conservateur), une source de chaleur.
: Facile, rapide et peu coûteux.
: Destruction de la faune par le liquide conservateur.
Etude des enchytréides (mésofaune)
L'entonnoir à eau
- A l'aide d'un carottier, prélever des échantillons de sol à différentes profondeurs (par tranches de 5 cm de profondeur).
- Extraire les enchytréides en utilisant un entonnoir à eau : disposer l'échantillon dans un filet de nylon de maille 2 mm sur l'entonnoir, lui même déposé sur un tube à essai rempli d'eau, recouvrir la surface d'un disque en verre ou en plastique, en évitant d'emprisonner les bulles d'air, disposer le dispositif sous une lampe chauffante.
- Les enchytréides fuient (la lumière et la chaleur) l'entonnoir en cherchant un milieu plus oxygéné en bas du tube à essai. Ils sont déposés dans une boîte de pétri et comptés à l'aide d'une loupe binoculaire et d'une feuille de papier quadrillée.
Matériel : Un carottier, un entonnoir, un filet de nylon, un tube à essai, un disque en verre, une lampe chauffante, une boîte de pétri et une loupe binoculaire.
: Efficace.
Etude de la microfaune
Les microorganismes jouent un rôle clé au niveau du recyclage de la matière organique dans le sol et de l’altération des minéraux en nutriments rendus accessibles aux plantes. Ces microorganismes aident aussi à stabiliser les agrégats du sol et entrent dans les circuits de régulation hydrique par l’excrétion d’exo-polysaccharides, qui participent à la rétention en eau du sol. Les micro-organismes rassemblent : bactéries, archées, levures, micro-algues et champignons filamenteux.
Les indicateurs microbiologiques du sol ont deux objectifs principaux : déterminer l’activité biologique d’un sol par l’intermédiaire de la décomposition de la matière organique et déterminer l’abondance ainsi que la diversité des micro-organismes du sol.
Etude des micro-arthropodes (de 100 µm à quelques mm)
L'extracteur de MacFadyen
- Enfoncer le carottier le plus profondément possible dans le sol (si le sol est difficile à pénétrer, commencer par entailler le sol avec une bêche afin de pratiquer deux ouvertures parallèles).
- Ouvrir le carottier puis découper la carotte au fur et à mesure à l'aide d'un couteau cranté. Fixer un capuchon de chaque côté de l'échantillon en indiquant le haut et le bas de la carotte.
- Extraire la mésofaune à l'aide de l'extracteur MacFadyen. Transférer les micro-arthropodes dans de l'alcool de conservation.
- Effectuer un tri et une reconnaissance des espèces sous la loupe binoculaire ou le microscope.
Matériel : Un carottier, un couteau cranté, des boîtes de prélèvements, un extracteur MacFadyen, une loupe binoculaire ou un microscope.
: Destruction de la faune.
Etude des nématodes
Pour l’ensemble de ces méthodes, la première étape consiste à prélever des échantillons de sol dans la strate 0-20 cm avec un carottier et se conclut par le comptage. Au final, on obtient l’abondance : nombre d'individus/m² (global ou par catégories écologiques), la biomasse : g/m² et la richesse : nombre d'espèces.
L'élutriation
- Matériel : Un carottier, un élutriateur d'Oostenbrinck, des tamis, une loupe binoculaire ou microscope.
- Extraire les nématodes par élutriation : lorsqu'un échantillon de sol est placé dans l'eau, les particules lourdes du sol sédimentent plus rapidement que les nématodes. Lors d'une élutriation, un courant d'eau ascendant maintenu constant permet d'empêcher la sédimentation des nématodes. Pour prélever les nématodes, passer le surnageant au travers d'un tamis et procéder au comptage.
La méthode de Cobb ou des seaux
- Matériel : Un carottier, 2 seaux, des tamis à maille 1 mm, un tamis à maille plus fine, un bécher ou un gobelet de lecture.
- Mélanger l'échantillon avec de l'eau par un brassage énergique dans un seau A puis laisser décanter.
- Lorsque la plus grande partie de la phase minérale est déposée au fond du seau A, passer l'eau dusurnageant du seau A dans un seau B à travers un tamis de 1 mm. Verser lentement l'eau du deuxième seau sur un tamis à maille fine pour retenir les nématodes.
- Récupérer les nématodes dans un bécher ou un gobelet de lecture.
La méthode des 2 fioles de Seinhorst
- Matériel : Un carottier, des béchers, des tamis, des erlenmeyers, des entonnoirs, une loupe binoculaire ou un microscope.
- Mélanger l'échantillon avec de l'eau dans un bécher puis passer la suspension boueuse à travers un tamis de maille de 1 à 2 mm afin d'éliminer les gros débris.
- La transférer dans un erlenmeyer A équipé d'un entonnoir. Le remplir d'eau puis le renverser sur un erlenmeyer B rempli d'eau de façon à ce que l'entonnoir de A plonge de 1 à 2 cm dans l'eau contenue dans B. Laisser 10 minutes environ (le sol tombe de A vers B).
- Renverser l'erlenmeyer A sur un bécher C plein d'eau pendant 10 à 20 min. Renverser B sur un bécher D plein d'eau. Puis renverser B sur C. Les contenus de A et B sont passés à travers un tamis de 40 à 50 μm et celui de C sur un tamis de 90 à 100 μm.
- Récupérer les nématodes.
- 50% des petits nématodes se trouvent dans l'erlenmeyer A et le reste dans B et C (qui contient 75% des plus gros). Le bécher D ne contient pratiquement pas de nématodes et son contenu est éliminé.
La méthode de l'entonnoir de Baermann et méthode de Baermann modifiée
- Matériel : Un carottier, un entonnoirs, un tamis, un tuyau souple, un filtre papier / tissu, un bécher, une loupe binoculaire ou un microscope.
- Un tamis est retenu dans la partie supérieure d'un entonnoir. L'extrémité du tube de l'entonnoir est équipée d'un tuyau souple clampé. Un filtre papier ou tissu est placé dans le tamis, l'échantillon de sol ou de broyat de végétaux à extraire est placé sur le tissu. De l'eau est versée dans l'entonnoir jusqu'au recouvrement de l'échantillon.
- Après une période de 12 heures à 3 jours, les nématodes mobiles ont traversé le tissu et se trouvent à l'extrémité inférieure de l'entonnoir. Ils sont récupérés dans un bécher en prélevant quelques ml en desserrant le clamp.
| Méthode | ||
|---|---|---|
| Elutriation | Echantillonnage :
débutant. Analyse : Expert. | |
| Cobb / des seaux | Simple. | Peu précis :
Sédimentation appréciée à l'œil. Efficacité des extractions très variables. Débutant. |
| Seinhorst | Permet de récupérer
les nématodes de taille petite à moyenne. L'appareil sépare l'extrait en plusieurs fractions : tamisage plus facile. |
Fragile.
Echantillonnage : débutant. Analyse : Expert. |
| Baermann | Permet de récupérer
les nématodes mobiles (si l'oxygénation est mauvaise, leur mobilité est réduite : méthode Baermann modifiée (utilisation d'une cuvette à la place d'un entonnoir)). |
Peu
efficace. Expert. |
Etude de l'activité biologique du sol
Pour déterminer l'activité biologique d'un sol on se base sur la décomposition de matières organiques.
En observant la dégradation de la matière, on calcule :
- Un taux de décomposition.
- Un taux de dioxyde de carbone libéré par la perte de masse du matériau partiellement ou totalement décomposé (courbes).
Ces tests sont réalisés à la fois sur terrain et en laboratoire par l'observation de la dégradation d'éléments. Une courbe des taux de décomposition précise nécessite généralement plusieurs points de données dans le temps, ce qui induit la nécessité d'être proche du site d'étude.
La méthode du slip en coton
- Matériel : Un slip en coton, blanc et bio.
- Enterrer un slip en coton blanc dans le sol que l'on souhaite étudié.
- Attendre environ 2 mois. Laver le sous-vêtement (pour enlever le sol) et observer la décomposition du coton.
- La couleur et les odeurs peuvent être étudiées. Elles indiquent des différences d'activité microbiologique. L'odeur est souvent du type "terreau", "humus", "champignons" dans les sols les plus actifs. Une odeur de renfermé, "moisi" oriente plus vers un sol présentant des problèmes tels que l'asphyxie racinaire par exemple.
La méthode du sachet de thé
- Matériel : Un sachet de thé (thé vert, Rooibos) et une balance. Possibilité d'utiliser des types de thé différents avec une décomposition lente ou rapide.
- Enterrer un sachet de thé dans le sol que l'on souhaite étudié en ayant pris soin de le peser avant.
- Attendre 3 mois. Peser à nouveau le sachet de thé et observer la décomposition des feuilles de thé.
LEVA-bag
- Matériel : Un sac de nylon, de la paille ou un LevaKit.
- Enterrer un sac de nylon (maille de 1 mm) rempli de paille dans le sol que l'on souhaite étudié en ayant pris soin de le peser avant.
- Attendre 4 mois. Peser à nouveau le sac en nylon et observer la décomposition de la paille.
Le test de Bait Lamina
- Matériel : des bandes en plastiques perforées, des appâts, de la lumière et un ordinateur (programme de matrice).
- Prendre des bandes de plastique PVC d'une longueur de 16 cm perforées de 16 trous. Remplir les trous appâts organiques (cellulose + son de blé + charbon actif). Insérez verticalement les bandes dans le sol et les laisser environ 14 jours.
- Retirez les bandes du sol, lavez les (pour éliminer les résidus de terre) et placez les bandes près d'une source lumineuse pour pouvoir dénombrer les appâts qui ont été mangés.
- On attribue des notes en relation avec la consommation des appâts (2 - appât totalement consommé ; 1 - appât partiellement consommé ; 0 - appât non consommé). On les reporte sur une matrice 16 x 16. On peut ainsi calculer un pourcentage d'activité alimentaire par couche de sol et par répliquât. Puis on peut en déduire l'activité alimentaire totale.
- La durée du test dépend de la saison, la température, l'humidité, du sol.
| Méthode | ||
|---|---|---|
| Slip en
coton |
Simple.
Facile d'utilisation. Méthode normalisée : permet de comparer les différentes données entre elles. Analyse de l'odeur et de la couleur. |
Ce n'est pas
un protocole scientifique établi. |
| Sachet
de thé |
Simple.
Peu coûteuse. Pratique. Méthode normalisée : permet de comparer les différentes données entre elles. |
Peu précis. |
| LEVA-bag | Simple.
Facile d'utilisation. Méthode normalisée : permet de comparer les différentes données entre elles. |
Peu précis.
Sensible aux conditions pédoclimatiques. |
| Test de Bait Lamina | Tout type de sol.
Peu coûteux. Rapide. |
Impossible sur
sols inondables ou très superficiels. Difficile dans des conditions climatiques ou géographiques extrêmes. |
Etude de la biomasse active du sol
Pour estimer la biomasse active des micro-organismes du sol, leur abondance et leur diversité, on peut étudier les échanges gazeux au cours de la respiration et la diversité microbienne globale d'un environnement par séquençage de l'ADN de tous les génomes présents dans cet environnement.
Ces mesures se font en laboratoire et nécessitent des préparations antérieures.
D'autres indicateurs nous informent de l'abondance et de la diversité des organismes comme la méthode par analyse des acides gras phospholipidiques (PLFA) et par analyse des lipides éther-phospholipidiques (PLEL) ou la méthode par analyse des acides gras phospholipidiques (PLFA) en utilisant la méthode simple d'extraction des PLFA (elles ne seront pas présentés).
Etude des échanges gazeux
L’activité respiratoire des microorganismes dépend de plusieurs facteurs, tels que le taux d’humidité du milieu et l’accessibilité aux nutriments présents dans le sol.
La technique MicroRespTM et SituResp
Cette technique mesure : la respiration basale du sol (les microorganismes actifs dans le sol catabolisent les matières organiques-nutriments présentes et accessibles dans ce sol) et la biomasse microbienne (tous les microorganismes actifs catabolisent le glucose solubilisé distribué en excès et leur dégagement de CO2 est proportionnel à leur biomasse).
- Matériel : Du matériel de prélèvement, des tamis, des plaques aux puits profonds, des joints, des microplaques, du substrat, une étuve, un spectrophotomètre.
- "L’empreinte catabolique" du sol (ajouts de divers substrats carbonés solubilisés, différents selon leur composition et l’origine qu’ils représentent).
- Il est nécessaire de préparer les microplaques de détection, les substrats et les microplaques à puits profonds :
- Les microplaques de détection : ces microplaques doivent être préparées une semaine avant utilisation et doivent être utilisées dans les trois semaines qui suivent. Les plaques doivent être conservées à l’obscurité dans un récipient étanche contenant de la chaux sodée (élimination du CO2) dont l’atmosphère est humide pour éviter la dessiccation du gel des plaques.
- Les microplaques à puits profonds : Peser la microplaque à puits profonds à vide. Chaque échantillon de sol est ensuite distribué volumétriquement de façon homogène dans les puits. Poser la microplaque à puits profonds sur une cale. Placer le dispositif de distribution avec sa plaque de fond sur la microplaque à puits profonds. Déposer les agrégats de sol sur le système (après avoir préalablement enlevé les restes de racines ou débris végétaux encore éventuellement présents). « Araser » délicatement les trous du distributeur (avec la main gantée). Une fois l’échantillon de sol distribué, faire glisser la plaque de fond pour permettre au sol de tomber dans chaque puits profonds de la microplaque. Peser à nouveau la microplaque après chaque distribution d’échantillon de sol, afin de connaitre précisément le poids moyen du sol par puits. Il est possible de mesurer sur une même microplaque la respiration de plusieurs échantillons de sol en remplissant une partie de la microplaque seulement. Placer du parafilm sur une partie de la microplaque à puits profonds et procéder comme indiqué ci-dessus. La microplaque est prête à recevoir les substrats.
- Prélever un échantillon de sol. Mélanger le sol et tamiser avec un tamis de maille 2 mm.
- Répartir l’échantillon dans des plaques à puits profonds, mettre différents substrats carbonés dans les puits (glucose, saccharose, tréhalose, cellulose, amidon, malate, acide oxalique, acide malique...). Les substrats sont préparés à la concentration de 120g/L. Les substrats dissous dans de l’eau distillée doivent être conservés à 4°C pendant 15 jours au maximum. Les substrats, avant contact avec le sol, doivent être mis à température du bio-essai. Dans chaque puits, 25 µl de substrat sera mis. Placer un joint d’étanchéité sur la plaque à puits profonds individualisant ainsi chaque puit. Recouvrir la plaque/joint d’une microplaque de détection contenant un gel agar et un indicateur coloré.
- Incuber les microplaques à l'étuve à 29°C pendant 6 heures.
- Mesurer le changement de couleur du gel par spectrophotomètre à une longueur d’onde de 570 nm. Le changement de couleur du gel agar est proportionnelle à la quantité de CO2 dégagée. Le dégagement de CO2 des puits dit "témoin" (aucun substrat ajouté) correspond à la respiration basale du sol.
La méthode par fumigation-extraction
- Matériel : Une étuve à vide, une pompe à vide, une ampoule à décanter (pour le lavage du chloroforme), des petits récipients en verre, une table agitatrice, une centrifugeuse, des pots de centrifugation, un analyseur de carbone organique dissous (COD).
- Prendre un échantillon de sol ayant un volume connu. Le diviser en deux lots : un lot témoin (non fumigé) et un lot fumigé. Le lot fumigé est traité par des vapeurs de chloroforme pendant 16 heures (dans un dessicateur sous vide).
- L'extraction du carbone organique est réalisée par agitation de l'échantillon dans du K2SO4 (0,05 N) pendant 45 min à 20°C. L'extraction est suivie d'une centrifugation à 6000g pendant 5 min pour séparer le culot de sol du surnageant (dans lequel sera quantifié le COD).
- On mesure le dosage par oxydation au persulfate sous rayonnement UV (appareil Dohrman DC 80) du carbone organique soluble.
- La différence du carbone organique soluble entre les deux types d'échantillons (fumigés et témoins non fumigés) donne la quantité de carbone "extractible" d'origine microbienne. Cette quantité peut être convertie en biomasse en utilisant un coefficient de proportionnalité (0,38) selon Chaussod et Houot (1993).
| Méthode | ||
|---|---|---|
| MicroResp
TM |
Sensibilité et sélectivité
des substrats permet de différencier les activités et discriminer les faibles niveaux. Simples. Peu coûteux. |
Manque de mesures (avec
des protocoles standardisés ou normalisés dans différents contextes) ce qui limite l'interprétation. Les variables environnementales ont une inflluence importante sur les paramètres. |
| Fumi-
gation- extraction |
Précis.
Peut être lié à d'autres mesures. Applicable aux sols non séchés fraîchement prélevés. |
Le référencement
reste à partager et à consolider entre les différents laboratoires mettant en œuvre cette mesure. Les vapeurs de chloroforme (fumigation) détruisent les cellules des micro-organismes vivants. |
Etude des génomes
Ces méthodes procèdent par l'extraction directe de l'ADN du sol. L'étude du génome permet de :
- Réaliser un inventaire des espèces en milieux difficiles.
- Inventaire des espèces difficiles à déterminer.
- Permet de détecter et suivre les espèces invasives.
- D'évaluer la qualité écologique des milieux.
- Suivre la modification des aires de distribution.
Attention, la présence d'ADN ne signifie pas toujours la présence d'organismes.
La méthode métagénomique
- Echantillonnage sur le terrain. Extraction de l'ADN. Séquençage de l'ADN. Analyse de la séquence
- Identification d'aspects fonctionnels du génome (sans forcément déterminer les espèces)
La méthode métabarcoding
- Echantillonnage sur le terrain. Extraction de l'ADN. Amplification de l'ADN (mitochondrial). Séquençage de l'ADN amplifié. Analyse de la séquence.
- Identification des espèces présentes dans l'échantillon.
Une vision encore partielle
Pour déterminer la qualité globale d’un sol, l’analyse d’un seul indicateur n’est pas pertinente. En effet, le sol est un milieu très complexe et en constante interaction avec l’écosystème environnant. Il est donc parfaitement logique de raisonner à plus grande échelle en se penchant sur plusieurs indicateurs à la fois, aussi bien des indicateurs sur la biologie des sols, sur les propriétés physiques et sur les propriétés chimiques.
Une analyse du sol peut aussi être réalisée par des experts. Il existe, par exemple, une méthodologie développée par les chercheurs de l’IRD et du Cirad pour évaluer la santé des sols en étudiant leur activité biologique : Biofunctool®. Cette méthode repose sur une évaluation multi-critères des trois fonctions essentielles à la vie du sol et des organismes qui le compose : la dynamique du carbone, le cycle des nutriments et le maintien de la structure du sol.
Cette analyse peut-être réalisée soit par les experts du Cirad et de l’IRD (dans le cadre de prestations ou dans le cadre de projet de recherche et développement), soit par des experts agronomes qui ont reçu la formation (2023).
Les indicateurs présentés ici sont spécifiques aux horizons d’un sol. Il existe d'autres indicateurs moins spécifiques aux sols, comme les escargots et les plantes dites indicatrices.
Sources
INRAE, SOLAE, Mégane PEREZ (2021), Contribution à l’appropriation et à la généralisation de l’utilisation d’indicateurs d’évaluation de la qualité des sols en Provence –Alpes – Côte d’Azur, rd-agri, https://opera-connaissances.chambres-agriculture.fr/doc_num.php?explnum_id=163817
Annexes